医疗器械有效性和生物相容性评价
依据《医疗器械监督管理条例》要求,医疗器械注册申报资料应包含产品技术要求,以及证明产品安全性和有效性的资料(包括生物学评价和临床前动物试验研究)和临床试验研究资料(适用时)。四川格林泰科拥有经过AAALAC国际认可的10,000余平方米SPF/普通级动物房,建有高标准的实验动物手术室(包括微创介入DSA平台),配备一般外科手术和显微手术设备和器材,由经验丰富的兽医带队,可开展骨科手术和心脑血管外科手术等,提供医疗器械有效性评价和生物相容性评价(非注册检验)解决方案。

服务内容
四川格林泰科生物科技有限公司提供医疗器械有效性和生物相容性评价服务。
我们的服务内容包括:
- 介入、植入物有效性评价
- 骨科材料评价
- 生物相容性评价:植入反应、全身毒性试验
部分项目经验:
- 骨缺损填充材料
- 心脏/肺脏射频消融、射频消融导管
- 射频消融导管
- 载药/不载药/降解/不降解微球
- 血栓切除导管
- 血流导向装置
- 覆膜支架
- 肠道支架
案例展示
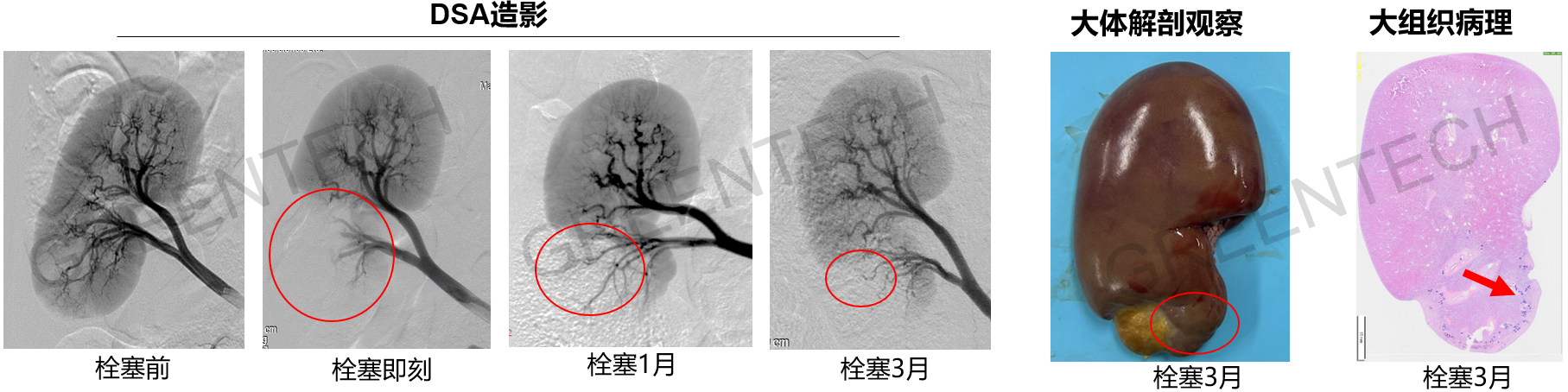
大白猪肾下极动脉栓塞
参考文献
《医疗器械监督管理条例(2017修订)》