老年痴呆模型
四川格林泰科拥有经验丰富的技术团队和成熟的技术平台,能为客户提供老年痴呆动物模型构建及体内药理学和药效学研究服务,适用于国内外IND申报。
老年痴呆简介
老年痴呆是一系列引起大脑异常改变的疾病的统称。阿尔茨海默症(Alzheimer's disease,AD)是最常见的一种老年痴呆,约占60-80%,是一种典型的以进行性认知障碍并伴有记忆力丧失为特征的中枢神经退行性疾病,临床表现为患者的认知功能和记忆功能逐步下降,典型病理特征为细胞外β淀粉样蛋白(Aβ)沉积形成老年斑(senile plaque,SP),细胞内Tau蛋白过度磷酸化形成神经纤维缠结(neurofibrillary tangles, NFTs),以及神经元丢失。AD的发病机制尚不明确,通常认为可能与Aβ沉积、Tau蛋白异常修饰、神经元丢失、突触丢失、氧化应激和神经炎症等因素相关(图1)。目前,全球范围内批准用于阿尔茨海默症治疗的药物的效果不尽人意,仅能缓解部分症状,亟需探索更多有效疗法。
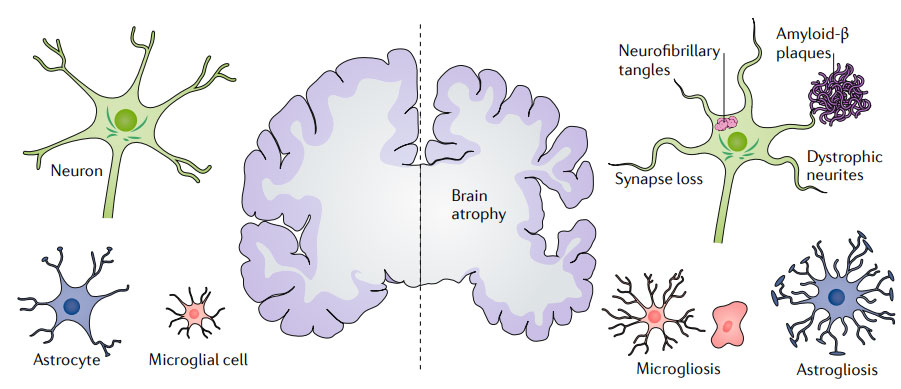
图1. 阿尔茨海默症的典型病理特征:脑萎缩、突触和神经元丢失、Aβ斑块、NTFs、营养不良的神经元突起、小胶质细胞和星形胶质细胞增生(Congdon & Sigurdsson 2018)。
可提供的老年痴呆动物模型
1、APP/PS1双转基因小鼠
转入人源β-淀粉样蛋白前体(APP)基因的小鼠表现出Aβ相关病理特征,引入PS1基因的APP/PS1双转基因小鼠相较于APP转基因小鼠,Aβ沉积和老年斑形成速度加快,学习记忆障碍显著提前,伴有神经元丢失、胶质增生和突触丢失等改变,是研究阿尔兹海默症的理想模型,导致早发型老年痴呆症。4月龄出现老年斑SP,6月龄出现Aβ沉积,10-12月龄出现记忆相关的行为学障碍。
应用:由于APP/PS1双转基因小鼠无法形成NFTs,适合用于靶向Aβ药物的非临床评价。
缺点:无神经退行性病变、脑萎缩和TNFs。
2、SAMP8小鼠 – 自发型衰老模型
SAM小鼠(Senescence accelerated mouse)呈现出加速衰老的表型,包含一系列近交品系,可分为P系和R系,P系为快速老化小鼠(Senescence accelerated mouse/prone, SAMP),4-6月龄时出现反应迟缓、学习记忆功能障碍等老化特征;R系为抗快速老化小鼠,作为SAMP的正常对照。SAMP8亚系与正常小鼠相比,寿命更短、学习和记忆能力不足,在增龄过程中,APP表达水平显著升高,大脑中呈现出类似人类Aβ和Tau病理学特征,伴有氧化损伤、乙酰胆碱转移酶活力降低等人类AD相关病理特征。
应用:广泛用于阿尔茨海默症和其他衰老相关疾病的机制和新药开发研究。自发表现出AD相关的病理改变,接近临床病程改变,尤其适合抗散发性阿尔茨海默症新药的非临床研究。
缺点:均一性较差、费用昂贵;很少出现Tau相关病理改变,不适合以Tau为药物靶点的新药研发。
3、东莨菪碱诱导模型 – 中枢胆碱系统损伤模型
东莨菪碱属于胆碱能拮抗药物,能穿过血脑屏障,抑制乙酰胆碱与受体结合,引发中枢胆碱系统紊乱,造成动物短期学习记忆障碍,可模拟AD患者行为的异常表现。向小鼠腹腔单次或多次注射东莨菪碱可引起脑内乙酰胆碱(ACh)水平显著下降,诱导AD动物模型。单次给药30min后即可出现明显学习记忆障碍,连续注射4周后,大鼠脑内Aβ和异常磷酸化Tau蛋白含量明显升高。
应用:适用于研究AD模型中的认知障碍和相关药物评价。
缺点:1、痴呆症状可逆;2、东莨菪碱对中枢M受体阻断为非特异性,动物可能出现焦虑、行动迟缓、自主活动增多等干扰行为学评价的不良反应。
动物种属
小鼠、大鼠
评价指标
1、神经行为学检测: Morris水迷宫实验(定位航行实验、空间探索实验)、避暗实验、新物体识别、巴恩斯迷宫、社交箱、旷场、转棒仪、高架十字迷宫等;
2、Aβ检测:1)ELISA检测Aβ含量(组织匀浆、血浆、脑脊液);2)老年斑组织染色(免疫组化);
3、Tau蛋白检测:WB法测定脑内过磷酸化Tau蛋白水平;
4、病理免疫组化:1)神经元数量;2)小胶质细胞数量;3)星形胶质细胞数量;4)NFTs;
5、大脑海马和皮层中AChE、ChAT活性及ACh含量测定,ELISA(东莨菪碱诱导模型);
6、神经炎症检测;
2、Aβ检测:1)ELISA检测Aβ含量(组织匀浆、血浆、脑脊液);2)老年斑组织染色(免疫组化);
3、Tau蛋白检测:WB法测定脑内过磷酸化Tau蛋白水平;
4、病理免疫组化:1)神经元数量;2)小胶质细胞数量;3)星形胶质细胞数量;4)NFTs;
5、大脑海马和皮层中AChE、ChAT活性及ACh含量测定,ELISA(东莨菪碱诱导模型);
6、神经炎症检测;
7、氧化应激检测。
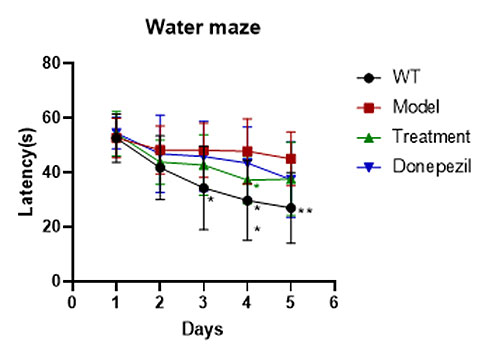
案例展示
阿尔茨海默症模型:APP/PS1双转基因小鼠
欢迎联系我们,共同探讨您的抗老年痴呆症新药研发项目,体验我们的服务。
参考文献
1. Congdon E E, Sigurdsson E M. Tau-targeting therapies for Alzheimer disease[J]. Nature Reviews Neurology, 2018, 14(7): 399-415.
2. Götz J, Bodea L G, Goedert M. Rodent models for Alzheimer disease[J]. Nature Reviews Neuroscience, 2018, 19(10): 583-598.
3. Canudas, A. M. et al. Hyperphosphorylation of microtubule- associated protein tau in senescenceaccelerated mouse (SAM). Mech. Ageing Dev. 126, 1300–1304 (2005).
4. Porquet, D. et al. Amyloid and tau pathology of familial Alzheimer’s disease APP/PS1 mouse model in a senescence phenotype background (SAMP8). Age 37, 9747 (2015).
5. Das T K, Jana P, Chakrabarti S K, et al. Curcumin Downregulates GSK3 and Cdk5 in Scopolamine-Induced Alzheimer’s Disease Rats Abrogating Aβ 40/42 and Tau Hyperphosphorylation[J]. Journal of Alzheimer's disease reports, 2019, 3(1): 257-267.
6. 黄龙舰, 赵春阳, 冯新红,等. 抗阿尔茨海默病药物非临床药效学评价体系的探索[J]. 药学学报, 2020, v.55(05):35-51.
2. Götz J, Bodea L G, Goedert M. Rodent models for Alzheimer disease[J]. Nature Reviews Neuroscience, 2018, 19(10): 583-598.
3. Canudas, A. M. et al. Hyperphosphorylation of microtubule- associated protein tau in senescenceaccelerated mouse (SAM). Mech. Ageing Dev. 126, 1300–1304 (2005).
4. Porquet, D. et al. Amyloid and tau pathology of familial Alzheimer’s disease APP/PS1 mouse model in a senescence phenotype background (SAMP8). Age 37, 9747 (2015).
5. Das T K, Jana P, Chakrabarti S K, et al. Curcumin Downregulates GSK3 and Cdk5 in Scopolamine-Induced Alzheimer’s Disease Rats Abrogating Aβ 40/42 and Tau Hyperphosphorylation[J]. Journal of Alzheimer's disease reports, 2019, 3(1): 257-267.
6. 黄龙舰, 赵春阳, 冯新红,等. 抗阿尔茨海默病药物非临床药效学评价体系的探索[J]. 药学学报, 2020, v.55(05):35-51.